Síndrome de intestino irritable

¿Qué vas a encontrar?
- 1 ¿Qué es el síndrome de intestino irritable?
- 2 Síntomas del Intestino irritable
- 3 ¿Cuánto dura una crisis de intestino irritable?
- 4 Causas el síntoma de intestino irritable
- 5 ‘Alimentos buenos’ para el intestino irritable
- 6 Resultados del estudio sobre intestino irritable y alergia sistémica al níquel
- 7 Mantente al día de las últimas novedades en salud y microbiota con nuestra newsletter
¿Qué es el síndrome de intestino irritable?
El Síndrome de Colon Irritable o Síndrome de Intestino Irritable (SII) es un trastorno de la interacción intestino-cerebro. Es el más común en el tracto gastrointestinal y su prevalencia alcanza valores de un 15-20% en países desarrollados (Defrees & Bailey, 2017).
Síntomas del Intestino irritable
Los síntomas del síndrome de intestino irritable son muy inespecíficos. Principalmente, constan de dolor abdominal crónico y/o malestar acompañado de movimientos intestinales anormales. Aunque los síntomas en mujeres son los mismos, estas presentan una incidencia de entre 1.5 y 2 veces mayor de síndrome de intestino irritable que los hombres (Principi et al., 2018).
¿Cómo se diagnostica el síndrome de intestino irritable?
La duración y severidad de los síntomas depende del factor precipitante, entre los que se des
No existen marcadores bioquímicos ni estructurales para el diagnóstico de esta enfermedad, por lo que para definir el síndrome de intestino irritable deben excluirse otras enfermedades orgánicas (Longstreth et al., 2006).
Se diagnostica en niños y adultos exclusivamente mediante criterios sintomatológicos y, de acuerdo con la definición más reciente, se utilizan los criterios de Roma IV.
Se define como un trastorno intestinal caracterizado por dolor abdominal recurrente, asociado a la defecación o con un cambio del hábito intestinal. Los síntomas deben prevalecer durante al menos 6 meses y estar presentes al menos 3 meses con anterioridad al diagnóstico. El dolor abdominal recurrente se refiere a la frecuencia de al menos un día a la semana, asociado con 2 o más de los siguientes criterios:
- Relacionado con la defecación.
- Asociado a un cambio en la frecuencia de las heces.
- Asociado a un cambio en el aspecto de las heces.
Existen diferentes subtipos de SII según la consistencia de las heces, pudiendo ser SII tipo diarrea, SII tipo estreñimiento, SII mixto o SII inespecífico. Como ya se comentó, el diagnóstico de síndrome de intestino irritable se puede hacer únicamente cuando se descarta la existencia de otras enfermedades orgánicas (Sebastián Domingo, 2017).

¿Cuánto dura una crisis de intestino irritable?
La duración y severidad de los síntomas depende del factor precipitante, entre los que se destacan:
- Cuadro posinfeccioso/postantibiótico
- Inducido por alimentos
- Vinculado al estrés
Por lo tanto, la duración variará dependiendo de la causa que predispone a su aparición. Cabe destacar que muchas veces se pasa de un subgrupo a otro, o en ocasiones, se interpretan de forma equivocada los síntomas.
Causas el síntoma de intestino irritable
Las causas del síndrome de intestino irritable no están claramente definidas, aunque durante muchos años ha sido considerado un desequilibrio del eje intestino-cerebro, debido a su asociación con trastornos de salud mental (depresión, ansiedad, somatización, entre otros). Hoy en día se conoce que existen otros factores, como las variaciones en genes implicados en la función intestinal, la activación inmune anormal, inflamación intestinal subclínica y alteraciones en la microbiota o disbiosis.
La disbiosis intestinal parece ser la causa más relevante. Existe una asociación entre la alteración de la microbiota y el colon irritable. Esto se conoce debido a que otros impulsores de la enfermedad (sobrepeso, estrés, infecciones intestinales, entre otros) están directamente derivados de las modificaciones en la composición de la microbiota. De hecho, se ha demostrado que la restauración de la eubiosis reduce o elimina los síntomas del síndrome de intestino irritable (Bhattarai et al., 2016, Ringel, 2017). Existen tres tipos de disbiosis que promueven el desarrollo de síndrome de intestino irritable:
Disbiosis postinfecciosa
El desarrollo del síndrome de intestino irritable se ha asociado con condiciones clínicas que causan disrupciones significativas en la microbiota intestinal. Tanto es así que en muchos casos, el síndrome de intestino irritable se ha diagnosticado tras una infección parasitaria o intestinal. Por ejemplo, pacientes que han sufrido de gastroenteritis tienen 7 veces mayor riesgo de desarrollar síndrome de intestino irritable en los 3 a 12 meses siguientes frente a los que no tienen este historial clínico. Algunos de estos patógenos son S. aureus, Shigella, E. coli, C. perfringens, B. cereus y Campylobacter spp. (Halvorson et al., 2006).
Ciertos estudios sugieren que la exposición a las toxinas de estos microorganismos promueven el desarrollo de una autoinmunidad, mediante la formación de anticuerpos anti-vinculina, una proteína citoesquelética responsable de la motilidad y función normal del epitelio intestinal (Suliman et al., 2020).
Disbiosis postantibiótica
La segunda causa potencial de disbiosis es el uso de antibióticos. Estos medicamentos, como hemos visto en anteriores artículos, alteran la composición de la microbiota intestinal favoreciendo el crecimiento de determinados organismos que pueden resultar patógenos a expensas de microorganismos beneficiosos como Lactobacilos y Bifidobacterias. Este cambio ha sido asociado al desarrollo del síndrome de intestino irritable. (Mayer et al., 2015).
SIBO (Small Intestinal Bacterial Overgrowth)
Por otro lado, el SIBO se encuentra en hasta un 78% de pacientes con SII, lo que nos indica que puede jugar un papel en su desarrollo. (Ghoshal et al., 2017).
‘Alimentos buenos’ para el intestino irritable
Aunque se ha postulado que ciertos alimentos pueden ayudar a controlar los síntomas, como el aloe vera (Ahluwalia et al., 2020), los resultados no son concluyentes. El aceite de menta parece tener efectos positivos, aunque es necesaria más investigación (Alammar et al., 2019).
El psyllium es una fibra soluble que mejora los síntomas del SII debido a su efecto prebiótico, enriqueciendo selectivamente ciertos géneros en la microbiota del hospedador. Ciertas dietas, como la mediterránea, la dieta baja en FODMAPs o la dieta libre de gluten no han tenido los resultados esperados cuando han sido llevadas a estudio e incluso pueden provocar cambios aberrantes en la microbiota (especialmente a largo plazo) (Bijkerk et al., 2009).
Concretamente, la dieta baja en FODMAPs puede mejorar los síntomas en pacientes con síndrome de intestino irritable, pero hasta en un 50% de las veces carece de eficacia, siendo costosa de mantener, altamente restrictiva y además modifica la microbiota de forma negativa (El-Salhy et al., 2019).
Por este motivo urgen otras terapias que ofrezcan alternativas sin riesgos para la salud en estos pacientes. Este es el caso de los probióticos, donde ciertas cepas reducen los síntomas de síndrome de intestino irritable aunque es necesario conocer las combinaciones y dosis necesarias (Dimidi & Whelan, 2020), por lo que el paciente debe acogerse a las recomendaciones de un especialista.
Resultados del estudio sobre intestino irritable y alergia sistémica al níquel
Debemos recordar que el tracto gastrointestinal es determinante en la función inmune, equilibrando las respuestas Th1/Th2 y modulando estos procesos alérgicos o de intolerancia. Diferentes factores del estilo de vida, como los hábitos alimenticios, pueden alterar profundamente la microbiota.
Una vez ha tenido lugar este desequilibrio en las diferentes poblaciones bacterianas, se produce una disrupción de la homeostasis en la mucosa del intestino, la cual tiene una estrecha relación con patologías como elsíndrome de intestino irritable (Aitoro et al., 2017).
Por ello, la microbiota intestinal es una potencial diana para la prevención y tratamiento de enfermedades que producen reacciones adversas a los alimentos. Tanto es así, que la evidencia científica más rigurosa y reciente relaciona la composición de la microbiota con el desarrollo del síndrome de intestino irritable, posicionando a los probióticos como una potencial forma de tratamiento (Principi et al., 2018).
A lo largo de los años ha podido observarse el efecto beneficioso de estos productos sobre los mecanismos patogénicos del SII por diversas vías, como el aumento de bacterias beneficiosas, reducción del número de patógenos y disminución de la inflamación asociada (Belizário et al., 2018).
Un estudio llevado a cabo recientemente sobre 40 pacientes (33 mujeres y 7 hombres) con sintomatología intestinal inespecífica, derivados a la unidad de alergología del Policlínico Gemelli de Roma, ha arrojado algo de luz acerca de la importancia de la implementación de probióticos en el tratamiento del síndrome de intestino irritable Figura 1).
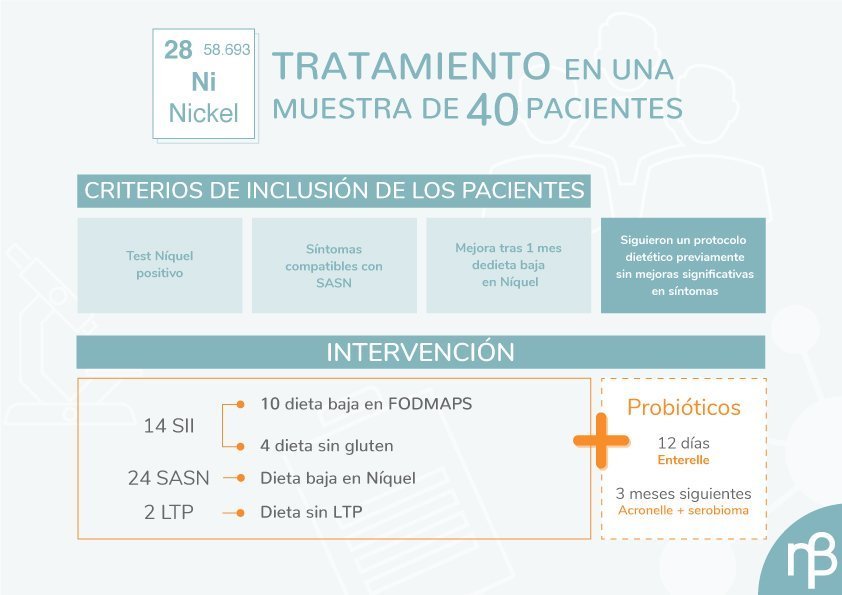
Los pacientes sujetos a estudio carecían de enfermedades orgánicas y habían seguido diferentes protocolos dietéticos, sin una remisión completa de los síntomas. Tras una evaluación gastroenterológica y alergológica, de los 40 pacientes se diagnostica a 14 de ellos de síndrome de intestino irritable a 24 de SASN y a los 2 restantes de intolerancia a la Proteína Transportadora de Lípidos (Lipid Transfer Protein: LTP).
Los criterios de inclusión fueron: resultado positivo para níquel en prueba cutánea, síntomas compatibles con SASN y mejora de al menos el 70% después de una dieta baja en níquel durante 1 mes (estimada mediante escala VAS: Visual Analogic Scale).
Todos los pacientes fueron evaluados al inicio del estudio para determinar una posible disbiosis intestinal mediante NGS (Next Generation Sequencing) de ARNr 16s. Los resultados indicaron que 31/40 (77.5%) pacientes presentaban disbiosis, incluso tras haber seguido intervenciones nutricionales personalizadas. Esto evidencia la capacidad limitada de un patrón alimenticio de revertir esta patología. Posteriormente, se procedió a una intervención con probióticos de forma paralela.
Los resultados tras los 3 meses de intervención quedan reflejados en la siguiente figura:

Puede comprobarse que inicialmente el 77.5% de pacientes presentaban disbiosis. Tras 3 meses de administración de probióticos específicos (Enterelle Plus, Acronelle, Serobioma), se realizó el mismo análisis a 25 pacientes, y los resultados mostraron eubiosis en 18 de 25 pacientes (72%).
Además de la mejora significativa de síntomas como náuseas, diarrea, reflujo, meteorismo y dolor abdominal, también hubo una mejora significativa para astenia y malestar general.
Estos resultados se mantuvieron incluso tras la interrupción de la suplementación, sin cambios en la escala VAS tras 2 semanas sin el uso de probióticos. El éxito en el tratamiento es debido a la correcta posología, origen y composición de los probióticos utilizados.
Estos tres factores determinan el éxito en el tratamiento por tres vías principales: administración adecuada en tiempo y dosis, origen humano, que garantiza una correcta adherencia al epitelio, tolerancia inmunitaria y acción no transitoria, a diferencia de productos de origen animal, y el uso de cepas concretas. Esto no sólo garantiza el efecto beneficioso de forma precisa y eficiente, sino que evita la posible competencia intra e interespecie.
Por lo tanto, pudo concluirse que tanto los pacientes con síndrome de intestino irritable como los sensibles al níquel tuvieron la misma mejora independientemente de la dieta. Por ello, puede afirmarse que la mejoría clínica es mayormente debida a la suplementación probiótica, y no tanto a las diferentes intervenciones en la dieta. Cabe destacar, además, que todos los pacientes experimentaron una mejora en su calidad de vida, estimado mediante IBS QoL (Inflamatory Bowel Disease Quality of Life).
Aunque la dieta baja en níquel es útil de forma puntual para mejorar los síntomas, es su asociación con probióticos lo que permite disminuir la frecuencia y severidad de manera definitiva posiblemente debido al aumento de diversidad y densidad microbiana.
Por lo tanto, la implementación de probióticos es crucial para el tratamiento y prevención de estas condiciones, ya que la homeostasis intestinal juega un papel determinante en estos pacientes (Caruso et al., 2020).

Nutribiótica está compuesta por un amplio equipo médico y científico que trabaja para divulgar de manera sencilla, atractiva y adaptada a todos los públicos contenido relacionado con la microbiota, la salud y el bienestar.

- #NBlog
- Puede que también te interese
En este artículo, repasaremos las últimas evidencias científicas relativas a esta...
Suscríbete a nuestra newsletter y sé el primero en enterarte de todas nuestras ofertas y promociones.